歌礼制药-B(01672.HK)商业化产品迎来收获期,销售收入同比增幅109.9%
作为港交所上市政策修改后首家生物科技类公司,歌礼制药-B (01672.HK)专注于抗病毒领域的研发,主要包括抗HCV(丙肝),HIV(艾滋病),HBV(乙肝)同类最佳创新药物的开发以及商业化,后续研发管线在抗病毒领域之外进一步向脂肪肝,肝癌等肝病领域扩展,业务涵盖从新药探索和开发直到生产和商业化的完整产业链。
昨日公司公告公布,截至2019年6月30日止中期,公司收入总额为人民币7540.3万元,其中,销售产品收入5535.6万元,同比大幅增长109.9%;推广服务收入2004.7万元,2018年同期并无推广服务收入。销售产品收入加推广服务收入,环比大幅增长52.7%。
商业化产品进入收获期
目前,歌礼制药共计拥有11款产品,其中两款核心产品已经获批上市:戈诺卫® (达诺瑞韦)以及聚乙二醇干扰素派罗欣®(聚乙二醇干扰素alfa-2a),此外另一款核心产品拉维达韦已获NMPA新药申请批准,并获得优先评审资格。
图表一:产品管线
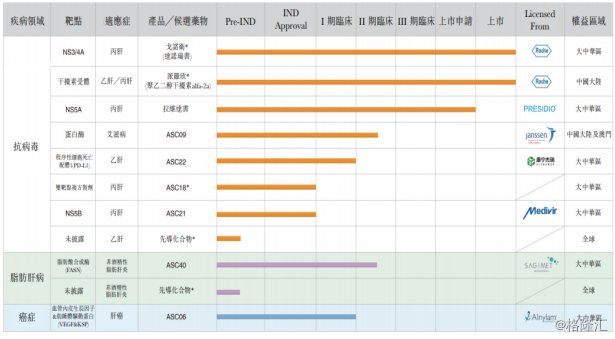
* 内部项目
附注: 本集团亦正在开发利托那韦片剂且已经完成用于健康人群的片剂生物等效性(BE)研究。于二零一九年八月二十二日,利托那韦的简略新药申请获NMPA的接纳。利托那韦用作戈诺卫®(达诺瑞韦)药代动力学助推剂。
数据来源:公司公告,格隆汇整理
戈诺卫® (达诺瑞韦):适用于丙肝治疗,已上市
歌礼制药首款商业化产品戈诺卫® (达诺瑞韦)自2018年6月获CFDA上市批准后,2019上半年销售快速放量,营业收入5535.6万元,同比增长109.9%,目前已纳入浙江省,天津和成都的基本医疗保险。
丙型肝炎是中国慢性肝病的主要病因(包括肝硬化和肝癌)之一。根据弗若斯沙利文数据统计显示,中国抗病毒药物市场将稳步增长,预计在2030年将达到1770亿元,其中中国丙肝药物市场于2028年将达到470亿元,占据中国整个抗病毒药物市场的33%份额。
目前针对丙肝中国主要的治疗方式为聚乙二醇干扰素和利巴韦林联合疗法,而戈诺卫®是一种创新型丙肝药物,可以直接作用的抗病毒剂及NS3/4A蛋白酶抑制剂,与聚乙二醇干扰素和利巴韦林共同服用时可获得较高的治愈率(97%)(SVR12)、更短的疗程(12周)及优异的安全性及耐受性表现。
在商业化团队方面,针对戈诺卫®产品,公司已建立约150人的商业化团队,战略性地覆盖位处中国丙型和乙型肝炎广泛的地区内超过1,000家医院及药房。此外,商业化团队已物色并培训肝炎领域约6,000名专家,并与多名分销商订立19份分销协议,从而直接或透过其子分销商涵盖371间高值药品直送(DTP)药房、医院关联药房和其他药房。
图表二:中国抗病毒药物市场
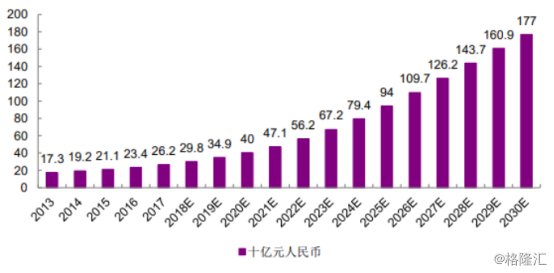
数据来源:弗若斯沙利文,格隆汇整理
派罗欣®(聚乙二醇干扰素alfa-2a):适用于乙肝/丙肝治疗,已上市
与上海罗氏合作的派罗欣®自2018年11月获得中国内地独家销售权后,2019上半年销售收入2004.7万元。
派罗欣®是一款经改良的长效干扰素(其为一种人体自然产生的抗病毒蛋白),并获批准用于治疗乙型肝炎及丙型肝炎。上海罗氏已在中国销售和推广派罗欣®超过15年,并得到了临床界的广泛认可与接受。与Nucleos(t)ide Analogues (NAs)相比,派罗欣®表现出强效的免疫调节作用,可致更高的HBeAg和HBsAg血清清除乃至血清转换。
拉维达韦:Best-in-Class,临近商业化
拉维达韦是一种同类最佳的,针对丙肝 NS5A 靶点位置的泛基因型 DAA。拉维达韦联合达诺瑞韦及利巴韦林的治疗方案是首种由中国国内公司开发的全口服、不含干扰素的三阶段临床实验已完成的 HCV 治疗方案。公司已向 NMPA 提交 NDA 申请并获得优先审批资格。
相较于同类竞争对手而言,根据公司披露的临床试验数据显示,拉维达韦的产品优势包括:(i)同类最佳NS5A抑制剂;(ii) 对1至6型基因具有泛基因型抗病毒活性;(iii) 对基线NS5A耐药突变HCV患者非常有效;(iv) 对难治的基因型有效;(v) 对肝硬化患者有效;(vi) 对HCV/HIV共同感染患者有效。
在研产品稳步推进
除了拥有两款已上市以及一款即将商业化产品外,歌礼制药已经从单纯专注于抗病毒乙肝以及丙肝领域,向HIV(艾滋病),脂肪肝以及癌症方面发展研究,在研产品正稳步推进。
PD-L1单抗ASC22,临床I期已完成
ASC22是一种首创免疫疗法,用于治疗乙肝以及其他病毒性疾病的PD-L1单抗,即将进入临床II期试验。ASC22不同于其他PD-1或PD-L1抗体,它是唯一一种针对PD-1或PD-L1的晚期单克隆抗体,给药途径为皮下注射,室温下药性稳定,并已从500多例肿瘤适应症患者身上取得临床安全数据,有望成为全球首创免疫疗法,为慢性乙型肝炎感染提供临床治疗。2019年1月,公司已从康宁杰瑞获得用于病毒适应症的ASC22(KN035)在大中华区的独家销售权利。
治疗丙肝药物ASC18:已获IND新药申请批准
ASC18是由公司自主研发的每日口服一次、每次一片的固定剂量双靶向复方制剂,用作治疗丙型肝炎的完整方案。ASC18是在戈诺卫®顺利推出后,一款用于丙型肝炎治疗上的NS5B核苷类聚合酶抑制剂。2019年8月1日,ASC18已获得研究性新药申请批准,临床试验预计将会很快开展。
治疗脂肪肝药物ASC40,临床II期
ASC40为一种用于治疗非酒精型脂肪肝炎的首创口服生物活性FASN抑制剂,已进入临床II期试验。FASN是DNL途径中的关键酶并催化棕榈酸酯的生物合成,棕榈酸酯随后可进一步转变成其他脂肪酸及复合脂质。FASN活性失调存在于许多不同疾病中,包括肝脏疾病及肝癌。非酒精性脂肪肝病(NAFLD)及NASH的晚期病症可发展为严重的肝脏疾病,包括肝硬化及肝细胞癌。第一例患者于2019年4月在全球临床II期试验中给药。
抗艾滋病药物ASC09,临床IIa期已完成
ASC09是用于HIV-1感染的潜在的同类最佳的蛋白酶抑制剂,目前已完成临床IIa期试验,计划2020年开展临床IIb试验。目前HIV/AIDs是无法进行医治的,针对HIV的药物主要是帮助患者延长寿命并预防HIV进一步传播,从而改善生活质量。蛋白酶抑制剂可以有效阻止处于生命周期不同阶段的病毒,并防止病毒的复制,当前Lopinabir为中国唯一一款上市的蛋白酶抑制剂。但由于HIV病毒变异率高,使用Lopinabir的患者可能会产生耐药性。ASC09拥有同类产品没有的基因耐药屏障,一旦进入商业化阶段,将有可能成为治疗HIV有效方式。
小结
无论是去年开始的“4+7”政策还是近日的新医保目录的调整,都在透露着创新研发药物将会成为中国医疗行业未来的发展重要的驱动力。
作为在港交所上市改革后首家Biotech公司,歌礼制药已经迎来了两款商业化产品落地,并开始初见成效。其中戈诺卫®已经开始进入部分医保目录,随着公司不断推进,有望在后续纳入国家医保目录中而受益。
而在创新药在研产品中,我们看到此次歌礼也在稳步推进相应进程,多款Best-in-class以及First-in-Class伴随着逐步进入临床后期开始商业化后,将会为公司带来更多的想象空间。
