自身免疫疾病新希望?中国抗体递交在港上市申请
作者:格隆汇·memory
近年来,医药生物行业越来越受到外界关注。无论是去年港交所修改上市条例,将未盈利生物制药企业纳入可上市范畴,还是即将上市的科创板,众多医药企业现身其中。根据wind数据统计显示,自今年以来,已有16家生物医药企业已经成功上市或在处理中,其中有7家公司主攻肿瘤领域,而关注到自身免疫性疾病的企业也有4家,包括此次递表港交所的中国抗体。中国抗体也是自港交所修改上市条例后,第一家递交上市申请的专注于免疫性疾病和慢性病的生物制药公司。
中国抗体是香港本土生物制药股,中金公司与东方证券国际为其联席保荐人,募集资金将主要用于研发及商业化核心产品,为其临床试验提供资金,以及建设苏州生产基地,用于核心产品的商业化规模生产。
图表一:2019年1月1日至7月12日香港医药股IPO状态
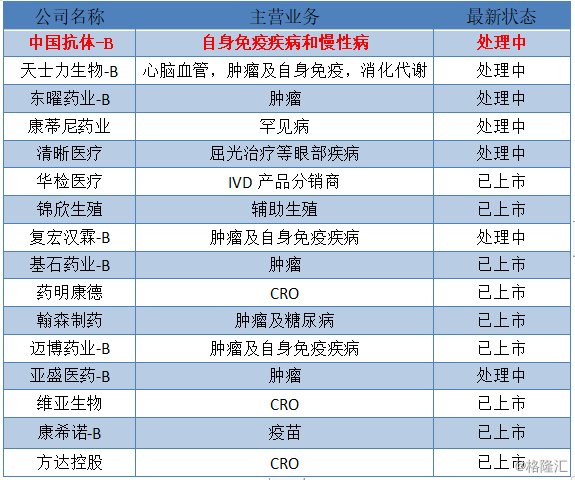
数据来源:港交所,格隆汇整理
“敌我不分”的自身免疫性疾病
人体的免疫系统就像一只纪律严明的军队,24小时昼夜不停的保护着我们的健康。可当这只军队“敌我不分”时,就将会为自身健康带来许多麻烦,科学家称之为出现自身免疫性疾病。
自身免疫疾病是由于免疫系统异常低活动或免疫系统过度活动导致身体免疫系统错误地攻击身体的情况,常见的自身免疫性疾病包括类风湿性关节炎(RA),系统性红斑狼疮(SLE),干燥综合症(SS),天皰疮,I型糖尿病,牛皮癣和多发性硬化(MS)。
事实上,全球关注如何有效治疗自身免疫性疾病的科学家不在少数。根据clinicaltrials.gov数据统计显示,截止2019年7月11日,全球在自身免疫性疾病新药获批研究数量达到11952项,其中中国拥有972项,占比8.13%。
图表一:自身免疫性疾病全球研究数量

数据来源:clinicaltrials.gov,格隆汇整理 数据截至2019年7月11日
而从已经上市的治疗自身免疫疾病药物市场来看,全球市场上十大最畅销药中有四种是关于治疗自身免疫疾病的药物。根据弗若斯特沙利文报告数据显示,全球排名前10的自身免疫性疾病2018年共计产生549亿美元销售额。中国自身免疫性疾病治疗市场在2014年至2018年中,年复合增长率较为缓慢,但以生物制剂作为治疗方式占市场总规模不断扩大。随着自身免疫性疾病诊断不断完善,预计生物制剂占总市场规模比例将从2018年的18.5%增长至2030年的66%,市场规模达到878亿元人民币。
图表三:中国自身免疫性疾病治疗市场规模
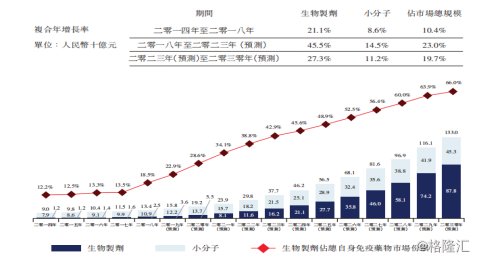 数据来源:公司公告,格隆汇整理
数据来源:公司公告,格隆汇整理
在研产品管线全面覆盖免疫领域
此次准备上市的中国抗体,在研产品管线囊括了整个免疫领域,且均为创新药物。首席执行官是公司创始人梁瑞安博士,曾为香港生物科技研究院院长,现任联交所生物科技咨询小组成员,主要负责制定整体战略方向,监控科学及临床试验及公司的整体运营。梁博士在分子免疫学及治疗单克隆抗体领域拥有近30年经验,是全球首位引入,发展及实现功能性人源化概念的科学家,也是首位成功发展人源化抗CD22单克隆抗体的科学家。
目前中国抗体在研产品包括已经到达临床III期研发的SM03在内的两项用于治疗多种自身免疫性疾病的在研药物以及四项处于新药研究阶段的在研药物,目标在于治疗类风湿性关节炎(RA),系统性红斑狼疮(SLE),哮喘,干燥综合症(SS),天疱疮以及其他免疫性疾病。
图表三:在研产品管线
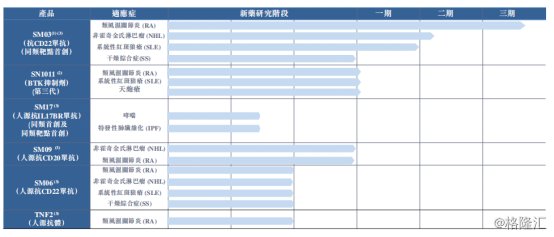
数据来源:公司公告,格隆汇整理
1. SM03: 全球首例抗CD22单抗药物
类风湿性关节炎是一种常见的自身免疫性疾病,多发生在40-60岁女性群体中,主要特征为手足等多处关节产生炎症,严重时可能导致关节畸形以及功能丧失。在当前的治疗方式中,没有永久性治疗方式,患者需要长期服用药物及护理来缓解症状。根据公司数据统计显示,全球类风湿性关节炎治疗市场2018年为628亿美元,而中国则达到77亿元,预计至2030年将达到833亿元。
目前,市面上常见的抗风湿性药物(DMARD)为甲氨蝶呤,如果患者对于甲氨蝶呤不耐受,可以使用来氟米特或柳氮磺胺吡啶等常规抗风湿性药物作为替代。倘若对于上述药品患者均反应不足,则建议使用新的作用机理进行治疗,抗CD22单抗及BTK抑制剂均是可行的抗类风湿性药物。
SM03为全球首例抗CD22单抗药物,其本质为一种重组免疫球蛋白IgG1单克隆抗体,能够选择性的靶向及结合B细胞受体(BCR)的联合受体CD22。CD22是在成熟的记忆B细胞上发现的细胞表面抗原,故而能够因B细胞失调导致的自身免疫疾病(如类风湿性关节炎及血液恶性肿瘤)时,以CD22为靶点进行治疗。
图表四:SM03作用机理
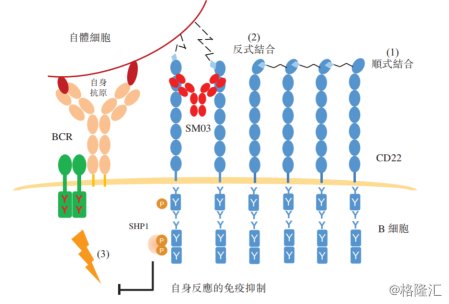
数据来源:公司公告,格隆汇整理
根据公司披露的研究数据显示,抗CD22抗体能够有效抑制类风湿性关节炎,系统性红斑狼疮,以及干燥综合症(SS)等自身免疫疾病,与其他参照物单抗药物相比,亲和力高近10倍,具有良好的耐受性。
目前SM03药物在中国处于适应症为类风湿性关节炎的临床III期试验,并预计2019年年底完成患者招募工作;适应症为系统性红斑狼疮及非霍奇金氏淋巴瘤为临床I期试验,预计2020年完成临床II期试验;而适应症为干燥综合征的正处于研究阶段.
2. SN1011:第三代BTK抑制剂
上世纪50年代,美国医生Ogden Carr Brution 首次报道X-连锁无丙种球蛋白症,后人发现其致病基因的基因编码,将一种新的蛋白酪氨酸激酶命名为BTK,为研究B细胞恶性增殖打开了全新的大门,从此,BTK抑制剂被广泛应用于抗肿瘤以及自身免疫性疾病当中。
第一代BTK抑制剂为依鲁替尼(Ibrutinib),由美国Pharmacyclics开发,主要用于治疗细胞淋巴癌以及慢性淋巴白血病等,被美国FDA评为突破性疗法。但根据目前的药物反馈而言,第一代BTK抑制剂存在停药后患者易发生进行性疾病以及出血,感染等危及生命的不良事件。
第二代BTK抑制剂例如Acalabrutinib在第一代的基础上进行改良,拥有更好的特异性,能够解决部分耐药性以及药毒性问题,目前对于慢性淋巴细胞白血病的试验已经进入III期临床试验阶段。
中国抗体的产品SN1011为第三代共价可逆BTK抑制剂,其设计在与治疗类风湿性关节炎,天皰疮以及系统性红斑狼疮。根据公司数据显示,相较于第一代BTK抑制剂,能够有效解决BTK抑制剂抑制时间过长而导致的不良反应。此外,SN1011能够通过合理的药物结构设计,对结构类似的非BTK展现出极低或者没有交叉反应性,从而赋予该分子对BTK的高选择性,这也大大降低了药物毒害性的可能性。
目前SN1011在澳洲处于临床I期试验,预计于2019年第四季度向中国药监局提交IND申请,2020年第一季度进行中国临床I期试验。
图表五:SN1011作用机理
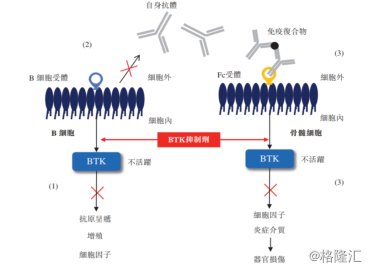
数据来源:公司公告,格隆汇整理
3. SM17:首款标靶抗体对应多种适应症
每当春天来临,万物复苏时,随处可见含苞待放的花朵,对花粉过敏者来说并非喜事。倘若一个人对花粉,螨虫,宠物皮屑等无害物质过敏,轻则浑身瘙痒,重则会导致肺部气道发炎和肿胀,表现出各种哮喘症状。中国的哮喘患者数量增长速度高于全球增长速度。根据公司公告数据显示,中国2018年哮喘患者数量达到2380万人,预计203年将增加至2780万人。
治疗过敏性哮喘的重点在于控制症状和降低恶化风险,在不同阶段给予不同药物,以增强患者的肺功能并增加康复的可能性。在治疗过敏性哮喘的后期,需要单抗技术进行治疗。目前Omalizumab是中国唯一一种治疗哮喘的单克隆抗体,仍在III期临床试验阶段,靶点为重组DNA衍生的人源化IgE。
中国抗体的SM17为首款标靶对应多种适应症,其中包括哮喘以及IPF(特发性肺纤维化)。SM17母源抗体可以显著减少气道中性白细胞增多,抑制鼻病毒家居哮喘模型中的气道嗜酸性粒细胞和淋巴细胞反应。这种独特的机制,可以让其靶向免疫系统中完全不同的细胞分子,为患者提供一个非竞争性,互为补充的治疗方案组合。
目前SM17正在通过全方位平台生成及收集数据,准备提交IND,预计2021年一季度进入临床I期试验。
研发,临床试验及生产一体化
拥有重磅产品的中国抗体,在未上市之前就已经进行了多轮融资。
通过WIND数据统计显示,中国抗体从2016开始进行A轮融资,直到2019年2月完成Pre-IPO融资计划,投资方包括上海杏泽投资以及中金资本,融资额已经达到数亿元。除此之外,中国抗体的收入均来自于非主营业务,譬如政府补贴以及银行利息等。
图表六:中国抗体财务摘要
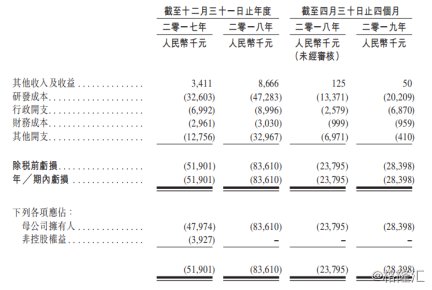
数据来源:公司公告,格隆汇整理
对于正在研发阶段的创新药企而言,是否能够带来收入乃至盈利,不仅要看是否拥有收入,更要看支出项,钱花到哪里去了。
中国抗体在支出中,占比最大的为研发成本。2017年公司研发成本3206万元,2018年增长至4728万元,同比增长47.47%,截至2019年4月30日,2019年研发支出已经达到2020万元。这些研发成本,将会随着研发进入临床后期,费用将会进一步增加。一旦已经进入临床III期的SM03走向商品化,研发成本将转化为销售收入,为公司带来现金流。
除此之外,与其他传统创新药企不同,中国抗体在研发初期阶段,并没有依靠外部企业进行初期生产,而是拥有自己的生产基地。中国抗体目前拥有两处生产基地,一处位于海南省海口市,现有生产能力达到1200升,满足临床以及初步营销需要。另一处位于江苏省苏州市,目前正在兴建商业化规模生产设施,将为SM03及产品系列中其他在研药物的商品化做好准备,预计2021年完工,生产能力将达到6000升。
小结
有望成为香港自修改上市条例以来首家香港本土的生物制药公司,拥有深圳,海口,苏州及澳大利亚都设立了研究中心及生产基地,生产无需依赖CMO进行生产。而最具有核心竞争力的全国首项SM03产品,预计今年年底将完成临床III期招募,如若药品成功上市,或将为中国抗体带来稳定的现金流。
