冬季流感重新来临,东阳是否还存在机会?
 作者 | 格隆汇 厚扬
作者 | 格隆汇 厚扬
数据支持 | 勾股大数据
每个行业都存在周期的机会,医药也是如此。冬季来临,连着两年流感疫情,让流感概念股东阳光药迎来一波又一波的机会,那么今年是否还有延续?逻辑是否还是一样?
1
近两年,尤其是今年,东阳的逻辑已经与往年不同,但是老生常谈,第一部分还是先讲一下最直观、影响最大、业绩释放最快的可威(磷酸奥司他韦)。
跟东阳光药久了的投资者,应该都很清楚,东阳的起家是“一颗神药定江山”。2002年成立时,东阳光药主要以原料药和制剂起家的,初期公司已经上市了23个品种,其实就包括了现在的主营产品可威、尔同舒、欧美宁、欣海宁、喜宁等,后来东阳光药将原料药业务改为“内供”,把公司管线的重心转向制剂。可威是罗氏(Roche)达菲(磷酸奥司他韦)的仿制药,达菲在1999年于美国获得FDA批准上市,2002年达菲进入中国市场。一般来说,原研药在专利期前,是不会出现仿制药的,达菲的核心专利在2017年才到期。因为2005年的时候,H5N1全球禽流感全面爆发,世界各国的订单大幅增加,罗氏的产能供应不足,为满足疫情的需要,各个国家出面跟罗氏谈判,要求行使专利强制许可权,以满足各国产能需求。罗氏承压放开专利授权,但要求药品必须由政府定向采购,当时中国的权益给了上海医药的子公司上海中西三维制药来生产(2005年12月),商用名为“奥尔菲”。三个月后(2006年3月),东阳光药因为早期参与过2004年解放军军事医学科学院毒物研究所的磷酸奥司他韦产品联合攻关项目,也具备了已通过欧美GMP认证的生产设施,技术上有资质制作奥司他韦原料药,所以也获得了罗氏的授权,即为“可威”。
2017年版医保目录,奥司他韦需要确诊为甲型流感才可报销,而2019年的新版医保目录,报销条件已经扩展至所有流感类型,意味着对报销支付对象放开,高危人群也可以适用,可威从疾病用药向防御性用药转移。颗粒剂型的报销条件改为仅对儿童,但是颗粒剂型的销售本就是以儿童为主体,成人患者会开胶囊处方,所以颗粒的报销条件改变对颗粒放量不会产生不良的影响。
就2019Q3单季,公司录得营收13.68亿,同比增长469.93%,增速大超预期。今年三季度高增速可能是因为,(1)通过这两年的流感疫情的爆发和学术推广的扩张,可威已逐步转为防御型用药,医院用药意识及患者的流感就诊率都有所提高,马上进入冬季的流感高峰期,流感用药备货有所上升;(2)目前奥司他韦是官方推荐的一线流感用药,18年卫健委在新版《流行性感冒治疗方案》中建议将奥司他韦列为流感的一线治疗方案,并扩大了处方范围,从重症甲型流感扩张至流感高危人,业绩释放加快;(3)销售渠道下沉,公司持续推动零售药房渠道的扩张,2019年Q1药店销售占比已经达到9%,目前占比已经超过10%。基层方面目前来看,颗粒的覆盖率会更好一点,但预计基层医院胶囊和颗粒都有大幅增长;(4)销售团队已扩大至3000多人(中期已有3123人),为后续的产品上市,公司预计还将增加销售人员。
对于可威这类抗病毒药物,渠道下沉是业绩释放的很重要环节,截止到2019年中期,可威胶囊覆盖三级医院1711家(2018H1:1366家),二级医院5854家(2018H1:4128家);可威颗粒覆盖三级医院1994家(2018H1:1635家),二级医院8185家(2018H1:6193家)。今年基层医院及OTC药房的增长显著,已经覆盖超过10万家OTC,OTC贡献占到10%,山东、吉林、陕西和四川高速增长;已经覆盖基层医院70444家,较2018年增长53%,基层医院收入占比提升至27%(2018年:25%),未来基层和OTC还将是驱动力,OTC端或与九州通进行战略联盟,联合九州通的基层销售团队加速下沉。
2
可威单品种支撑公司发展与股价并不是一个长久的良策,罗氏的奥司他韦专利自2016年2月开始陆续到期,核心化合物专利在2017年到期。东阳光和罗氏的专利授权协议方面,罗氏同意降低专利费率约 30%,有效期至授权许可的专利中最后一个专利到期之日(2024 年),预计2024年会达到峰值;颗粒剂到2026年到期。竞品方面,罗氏(Roche)在2018年10月Xofluza(baloxavir marboxil),这个被成为“20年来首个流感新药”,临床试验上,Xofluza单次治疗即可大幅减少流感症状持续时间,并在仅仅一天内就使病毒排出明显减少,适用人群为12岁及以上急性、无并发症流感患者。给药周期大大降低,给药的便利性大大提高,这也是市场考量是否会对可威有冲击的地方,但目前罗氏还未进入中国市场,且儿童并不在患者群体中,可威的颗粒剂型优势还是明显的。
关于竞品方面,日本企业盐野义研发的Xofluza,可以通过抑制流感病毒自身 mRNA 的转录来实现抗病毒效果。临床试验证明Xofluza的单次给药效果优于奥司他韦的每日两次给药,仅一天内就使病毒排出明显减少,适用人群为12岁及以上急性、无并发症流感患者。给药周期大大降低,给药的便利性大大提高,罗氏旗下基因泰克与盐野义签署商业许可协议并获得了美国地区的共同销售权。Xofluza是被称为“20年来首个流感新药”,短期内不会对奥司他韦和其他的OTC抗病毒药物有太大的冲击,且可威具有颗粒剂型儿童用药的优势,短期内,不会对公司的可威业绩造成影响。
3
但既然风险是可预见的,补充管线便是解决的良策。
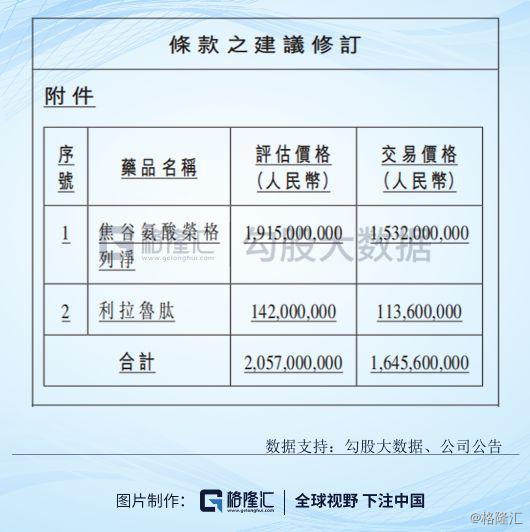
2019年11月13日,东阳光药发布公告,公司与广东东阳光药业订立购买协议,公司向广东东阳光药业收购两种治疗2型糖尿病的药品,分别为焦谷氨酸荣格列净和利拉鲁肽,当时的总代价为人民币20.57亿元,公告出来后,市场反响并没有很好,糖尿病竞争格局激烈且有集采的压力在。
公司于12月27日发布的补充公告,将收购总代价修改为总评估值的80%,即16.456亿元,其中荣格列净15.32亿元,利拉鲁肽1.136亿元。
(资料来源:公司公告)
补充条款中,修改后总代价16.456亿元将分为三期款项支付,首付款5.5亿将于协议生效后的30日一次性支付;第二期款项约2.47亿元,完成单品3期临床时,将支付5%,向国家药监局递交药品注册申请后支付5%,上市公司登记为上市许可持有人将支付5%。尾款支付更像一个对赌协议,尾款约8.49亿,在2027年、2028年、2029年三个年度,或者在2029年之前的任何三个连续年度累计营业收入达到100.97亿元或以上,公司一次性向广东东阳光药业一次性支付尾款;如果未能达到这个营业额,公司需要向广东东阳光药业支付尾款=人民币16.456亿元 × 2027年、2028年、2029年累计营业收入÷人民币100.97亿元–人民币7.9684亿元,其实就是按照营业额的比例支付尾款,如果最后公式结果为正数,公司向广东东阳光药业支付尾款,如果为负数,则由广东东阳光药业向公司退还款项,并按照产品购买协议签署日全国银行间同业拆借中心最新公布的贷款市场报价利率(LPR)向公司支付占用该笔款项期间的利息。

(资料来源:公司公告)
变动主要是两个, 一个是总代价和首付款、第二期付款都减少不少,解决了市场觉得估值太贵承担风险较大的担忧;第二个是对赌的时间拉长了,之前为“上市第一财年达到15亿以上,公司将支付1.0285亿元,上市第二财年达到25亿以上的销售目标,公司将支付2.057亿元,上市第三财年销售实现35亿元以上,公司将支付1.057亿元”,现在延期至2027~2029年,但是销售目标提高,赔偿条款加重,对公司沉淀做业绩释放长远布局其实是好事,但是短期内的业绩大幅增量可能就不会那么快见到。
焦谷氨酸荣格列净为国家1类创新药,作用机制为一种钠-葡萄糖协同转运蛋白-2(SGLT-2)抑制剂,拟用于治疗2型糖尿病,正在准备工作即将开展三期临床试验。
SGLT-2抑制剂一直被认为有望成为口服降糖药的后起之秀,SGLT-2抑制剂可以通过抑制SGLT-2功能从而降低肾小管葡萄糖重吸收,以及通过尿液葡萄糖过度排泄而降血糖。因为糖尿病患者经常伴有心血管疾病等,所以患者用药的频率高,相应的诊疗费用也高,患者的财务负担较大,但已经上市的以达格列净为首的SGLT-2抑制剂临床数据显示,SGLT-2抑制剂可以使得糖尿病患者降糖的同时起到保护心血管的疗效。所以从2012年第一个SGLT-2获批开始,销售增速逐年递增显著,2017年全球的销售规模达到26.32亿美元,占到糖尿病市场的6.5%。国内市场,第一个获批上市的SGLT-2抑制剂是阿斯利康的达格列净于2017年3月在国内上市,半年后(2017年9月)勃林格殷格翰的恩格列净与西安杨森的卡格列净相继获批上市。全球市场同品种,FDA在2017年12月批准了默沙东的埃格列净上市,是全球第七个SGLT-2抑制剂。专利期分别为达格列净到2022年,卡格列净到2023年,恩格列净到2024年,埃格列净到2028年。
SGLT-2跟二甲双胍相比较,在2018年的《中国2型糖尿病防治指南》中写道,SGLT-2可以对于二甲双胍单药治疗血糖控制不住的患者,可以在早期联合SGLT-2联合用药, 因为SGLT-2降糖效果与二甲双胍不分伯仲,而SGLT-2还具备心血管增益的疗效,单药治疗也不会增加低血糖的风险,意味着对患者用药角度,SGLT-2更优于二甲双胍,SGLT-2替代性的空间存在。
东阳收购的荣格列净是对标达格列净,因此在定价角度,预计也参考达格列净的定价,达格列净2018年全球销售额达到8.4亿美元,管理层表示,荣格列净2023年有望达到2个亿,上市的第5年有望达到峰值20亿元。
另一个品种,利拉鲁肽为生物制剂,作用机制为一种胰高血糖素样肽-1 (GLP-1) 受体激动剂,拟用于治疗2型糖尿病,正在准备工作即将同步开展一期及三期临床试验。在国外,GLP-1被定义为一线或二线用药,国内之前一直是三线治疗方案。2018年1月,中华医学会糖尿病学会分(CDS)所编写的《中国2型糖尿病防治指南》里明确指出,GLP-1已提升至二联治疗方案之一,无法被二甲双胍单药所控制的患者,可以在早期运用GLP-1进行联合注射治疗,临床地位进一步提高,逐步接轨国际市场,对GLP-1扩大市场规模起到积极的正向作用。
目前国内GLP-1受体激动剂格局为艾塞那肽、艾塞那肽微球、利拉鲁肽、利司那肽和贝那鲁肽。艾塞那肽和利拉鲁肽为第一梯队上市的GLP-1受体激动剂,因为上市早,先发优势显著,市场规模优势明显。二梯队的上市时间比较集中,但利司那肽和贝那鲁肽在疗效和价格上相较艾塞那肽和利拉鲁肽并没有明显的优势,所以市场规模增速比较缓慢。

GLP-1的国内竞争格局也很激烈,近期的谈判目录,媒体流传出的三生的艾塞那肽降价5%续签医保的新闻,未来GLP-1这个赛道,依然是个价格战的赛道。三生的艾塞那肽微球,相较于其他GLP-1产品每日皮下注射一次的用药次数,百达扬的可以实现一周一次给药,目前也是国内首个、唯一一个可以一周一次给药的长效GLP-1药物。百达扬的活性成分虽也为艾塞那肽,但其是将艾塞那肽进行PLGA(Poly lactic-co-glycolic acid, 聚乙交酯-丙交酯共聚物)微球化后所制成的长效制剂型产品,药物分子包埋在PLGA微球当中,通过扩散-溶蚀方式向注射部位周围组织缓慢释出,从而实现了一周给药一次,在保证降糖疗效的同时,大大缩减患者的时间成本,提高了患者的依从性,减少了医护人员的工作量和出错风险。
竞争对手方面,因为长效GLP-1本身壁垒较高,目前国内只有礼来的度拉鲁肽和江苏豪森药业的聚乙二醇洛塞那肽注射液在申报上市的阶段,A股的糖尿病领域龙头通化东宝(600867.SH)在2017年11月拿下利拉鲁肽的临床申请,度拉鲁肽目前正处于临床前研究。
竞争激烈程度,不仅仅是处于临床的产品颇多,长效在患者用药上有优势,三生的微球技术也更胜一筹,东阳在这个品种的竞争格局还是比较激烈的,所以东阳要拼利拉鲁肽的准入,才是突破口,准入的成功才是销量释放的突破口。管理层预计2023年上市,2024年争取占到GLP-1国内市场份额的10%,超过1亿,上市第5年达到峰值。
收购条款,一般市场的反应之一都是这笔收购贵还是不贵。此次的收购条款中给出,总代价20.57亿元将分为三期款项支付,首付款10.285亿(总代价的50%)将于协议生效后的30日一次性支付;第二期款项5.1425亿元,完成单品3期临床时,将支付7.5%,向国家药监局递交药品注册申请后支付7.5%,上市公司登记为上市许可持有人将支付10%。尾款支付更像一个对赌协议,尾款25%(5.1425亿元)将分三期支付,上市第一财年达到15亿以上,公司将支付1.0285亿元,上市第二财年达到25亿以上的销售目标,公司将支付2.057亿元,上市第三财年销售实现35亿元以上,公司将支付1.057亿元。
总体来说,有对赌协议一定是利好的,风险就在于,市场的竞争格局是否真如公司所预期,公司的销售团队,虽然可威团队实力已得到证实,但是还未有其他的糖尿病药物的前列参考,可以长期跟踪,若前期仿制药及公司胰岛素销量可观,后续的品种会更有信心。
4
小结
接下来,公司在丙肝和糖尿病两个大病种领域已经做好了布局,除了上述糖尿病的布局,东阳在丙肝上的布局有自主研发依米他韦(NS5A抑制剂类抗丙肝病毒DAA药物),还有太景生物(4157.TWO)研发的伏拉瑞韦(NS3/4A抑制剂类抗丙肝病毒DAA药物)也与东阳光集团签署了合作协议书,这两个1.1类抗丙肝新药联合进行临床开发,组成全口服免干扰素治愈丙肝的药物组合。东阳光药的依米他韦有望成为国产版的索磷布韦(生产药企:吉利德)。目前国内进行全口服免干扰素在研药物中,东阳光药、歌礼药业,北京凯因格领生物、银杏树药业、常州寅盛药业的临床走在前列,但从联合用药的临床来看,东阳光药开展的临床是最多的,2023年DAA疗法有望替代传统PR方案,此次谈判目录其实已经看出,国内的丙肝竞争已经全面拉,国产与外企的竞争也越发的激烈,是个大市场,也是个激烈的市场。
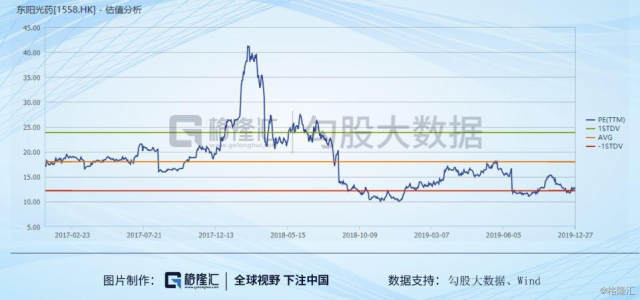
从短期投资来看,可威的下沉放量还远有空白区域去填补,对公司短期业绩刺激存在,年报的数据可预期和期待,明年的中长线(1年),看今年集采及新药上市的情况,可持续关注,短期(3个月)冬季短期刺激明显存在,从已经披露的前三季度数据,全年的业绩向好,目前12.9倍的PE(TTM),存在空间。