永泰生物-B(6978.HK):CAR-T-19获批进入临床试验,当日最高涨幅达8%
12月28日,永泰生物-B(6978.HK)发布公告,其在研产品CAR-T-19注射液以B细胞急性淋巴细胞白血病(B-ALL) 为临床适应症,已获得国家药品监督管理局药品评审中心批准新药临床试验(IND)申请,可以进行临床试验,预计2021年开展临床试验。受公告利好影响,永泰生物-B(6978.HK)高开高走,最高涨幅达到11.02港元/股,截至当日收盘,收盘价11.00港元/股,涨幅达到7.84%,创公司近3个月新高。
图表一:永泰生物走势图
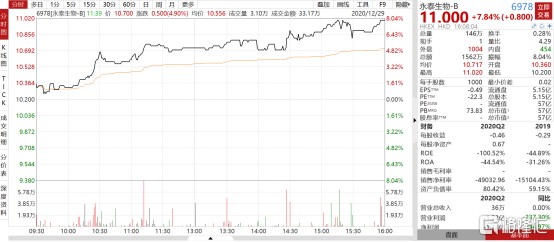
数据来源:WIND,格隆汇整理 数据截至2020年12月29日
中国细胞免疫治疗迎来十年爆发期
肿瘤疾病,人类死亡的一大杀手。伴随着科技技术的发展,细胞免疫治疗方式正在引领抗癌治疗进入新的时代。
与传统的癌症治疗药物不同,CAR-T 细胞疗法主要是利用 T 细胞启动人体自然宿主防御机制。CAR-T 可以在识别肿瘤抗原时无需主要组织相容性复合体(MHC)的限制,能够识别 MHC 非依赖型靶标,同时通过共刺激性分子信号增强 T 细胞免疫的杀伤性,从而克服由于肿瘤细胞下调 MHC 表达或抑制共刺激分子分泌而造成的免疫逃逸。
CAR-T 疗法在血液肿瘤方面取得显着进展,尤其是在 CD19-CAR-T 方面。CD19 表达于大多数B系淋巴瘤细胞,而不存在于造血干细胞和正常组织中。根据目前全球已完成及正在进行的 CAR-T 临床试验,以 CD19 作为靶点接近一半,CD19 已成为当前 CAR-T 免疫治疗最重要的分子生物标志物。
图表二:CAR-T细胞疗法应用癌症领域(图左)与设及靶点(图右)
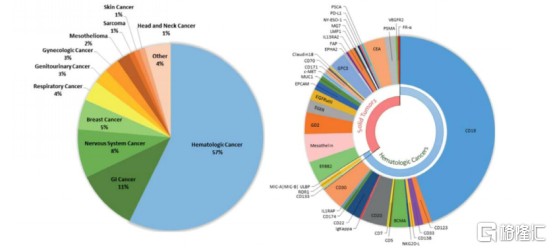
数据来源:F. Arabi et al,山西证券,格隆汇整理
从市场规模上来看,中国细胞免疫治疗将在未来十年中迎来黄金时期,带来爆发式增长。根据Frost&Sullivan数据统计显示,中国细胞免疫治疗产品市场规模预计2021年至2023年由13亿元增长至102亿元,复合年增长率达到181.5%。
图表三:中国细胞免疫治疗市场规模

数据来源:Frost&Sullivan,格隆汇整理
细胞治疗有望为ALL带来希望
白血病是一类造血干细胞恶性克隆性疾病。根据白血病的分化程度、自然病程的长短可分为急、慢性白血病。
其中,急性淋巴细胞白血病(ALL)是急性白血病的亚型之一,在儿童中比较常见。急性淋巴细胞白血病(ALL)主要表现在未成熟的血细胞数量快速增加,而其血细胞的DNA被破坏,并且不能生长成为正常细胞。
根据Frost&Sullivan数据统计显示,ALL患者的新增病例从2014年的1.16万例增加至2018年的1.24万例,年复合增长率达到1.7%,预计2030年将达到1.47万例。2018年,在中国 约 有10,700名18岁以下儿童新增患上ALL,占于中国的ALL患者总数86.3%。由于早期筛查的发展,估计于2023年将达到1.34万例,于2030年将达到1.47万例。
在ALL患者中,有75%的CD19阳性表达的B细胞急性淋巴细胞白血病(B-ALL)。根据Frost&Sullivan数据统计显示,2015年中国约有1.2万名新增B-ALL患者,其中难治复发型(R/R B-ALL)患者占30%。
儿童作为常见ALL患病人群,很难接受传统高强度长时间的化疗方式进行治疗,但由于靶点治疗和细胞免疫治疗副作用相对较少,或许可以成为用于治疗儿童的R/R ALL的有效方式,目前细胞免疫治疗已经在卫健委颁布的指南中被推荐用于治疗儿童急性淋巴细胞白血病。
CAR-T-19获批临床,有效性与安全性有望更优
2012 年,在 Carl June 的一项针对儿童 B 细胞急性淋巴细胞白血病的 CAR-T 临床试验中,一个名叫 Emily的急性白血病患儿在二次复发无药可治的情况下,通过靶向 CD19 的 CAR-T 治疗,三周后肿瘤完全消失,至今 Emily 依然健康的活着,可以说 CAR-T 创造了人类历史上的医学奇迹,给无数癌症患者带来的新的希望。
2017 年美国 FDA 批准了两项靶向 CD19 的 CAR-T 细胞疗法上市,即诺华的Kmriah和 Kite的Yescarta,分别用于治疗儿童和青少年的急性淋巴细胞白血病(ALL)和特定类型的非霍奇金淋巴瘤(NHL)。
而永泰生物此次获批用于治疗B细胞急性淋巴细胞白血病(B-ALL)进入临床试验的CAR-T-19注射液,是公司在CAR-T细胞产品中首款在研产品,成为继核心在研产品EAL之后又一获批开展临床试验的创新药物。CAR-T-19注射液预计将于2021年展开临床试验。
从公司此前在招股书中披露的体内药效学实验来看,在2017年6月至2018年9月期间,在共计63名受试者中,CAR-T-19具有一定的有效性和安全性优势,相较于其他同类治疗产品有望疗效更好。具体来看:
(1)客观缓释率(ORR)达到98.21%。
(2)完全缓释率(CR)达到94.64%,远高于同期目前全球已经上市用于治疗r/r ALL的药物,例如惠氏制药的Inotuzumab(CR:80.7%),安进的Blinatumomab(CR: 43%),以及诺华制药的Tisagenlecleucel(CR:81%)。
图表四:全球已上市的针对r/r ALL的代表药物

数据来源:Insight,山西证券,格隆汇整理
(3)在有效性上,CAR-T-19在12个月整体生存率高于80%,高于诺华制药的Kymriah的76%。
(4)在安全性上,细胞因子释放综合征(CRS)是最常见及最严重的不良反应,CAR-T-19相较于诺华制药不良反应率较低,其中大多数反应程度较轻。
图表五:永泰生物CAR-T-19与诺华产品对比

数据来源:公司招股说明书,格隆汇整理
小结
伴随着新一轮医保谈判落下帷幕,鼓励创新研发成为一系列医改政策的背后逻辑。而以CAR-T为代表的细胞疗法,也正在逐步在国内外市场上大放异彩,在未来十年中有望迎来爆发期,国内市场规模在2030年达到584亿元。
根据山西证券的预测,假设国内CAR-T治疗ALL患者费用为30万元,CAR-T在国内的渗透率为30%和40%的情况下,针对ALL的市场空间分别为2.34亿元和3.12亿元。
作为细胞治疗第一股,永泰生物在上市之初就吸引了众多投资者的目光。此次获批进入临床的CAR-T-19,更是在数据上安全性以及有效性上更优,有望为ALL患者带来希望。随着CAR-T-19产品进入临床试验,估值有望进一步提升,值得关注与期待。
相关证券:- 永泰生物-B(06978)
