有一家外企加入 ADC赛道火爆异常 本土企业出位机遇几何
《科创板日报》(上海,记者 徐红),正当国产ADC蓄势待发的时候,外企却似已有领先之势。
10日,国家药监局药品审评中心(CDE)公示,安斯泰来(Astellas)在中国提交了2项注射用enfortumab vedotin的临床试验申请,并获得受理。
公开资料显示,Padcev(enfortumab vedotin)是由安斯泰来和西雅图遗传学公司(Seattle Genetics)联合开发的一款靶向Nectin-4的抗体-药物偶联物(Antibody Drug Conjugates,ADC),于2019年12月获美国FDA批准上市,用于治疗局部晚期或转移性尿路上皮癌(UC,最常见的膀胱癌类型)患者。这也是该产品首次在中国申报临床。
ADC药物由单克隆抗体和强效毒性药物通过生物活性连接器偶联而成,是一种融合了小分子药物细胞毒性和抗体靶向作用的强效抗癌药物,又被称为“智能生物导弹”。自2019年美国FDA在一年里史无前例地一连批准三款产品上市以来,ADC药物的热度正变得越来越高。
值得一提的是,Padcev并非首个进军国内市场的进口ADC药物。在此之前,罗氏的赫赛莱(英文商品名:Kadcyla;通用名:恩美曲妥珠单抗)以及武田制药的维布妥昔单抗(Brentuximab vedotin,Adcetris)已分别与今年1月和5月获国家药监局批准上市,成为国内最早上市的两款ADC药物,且均为进口品种。
其中,罗氏Kadcyla主要用于治疗HER2阳性乳腺癌,Adcetris获美国FDA批准的适应症包括经典霍奇金淋巴瘤(cHL)、间变性大细胞淋巴瘤(ALCL)、外周T细胞淋巴瘤(PTCL)和蕈样肉芽肿(MF)等,这两款产品也是全球最早获批上市的ADC药物。
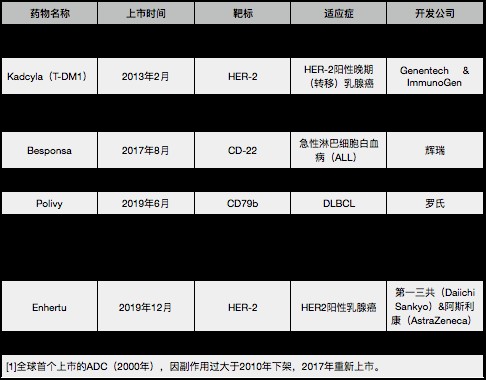
图|截至目前,全球共有9款已上市的ADC药物;统计:《科创板日报》
国内方面,荣昌生物于今年8月20日提交了抗HER2抗体药物偶联物纬迪西妥单抗(Disitamab vedotin,RC48,爱地希)的上市申请,根据公司港交所招股书推测此次RC48提交的适应症应为胃癌,这也是首个报上市的国产ADC药物。
Insight数据库显示,目前国内正在开展的ADC药物临床试验有超过50项,除了荣昌生物的RC48以外,其中还有约10来项已处于III期临床阶段,包括东曜药业的TAA013、百奥泰(688177.SH)的BAT8001等。值得注意的是,在这些已经开展临床实验的产品中,有很大一部分都是靶向HER2靶点,显示在HER2-ADC这条赛道上,竞争已经相当白热化。
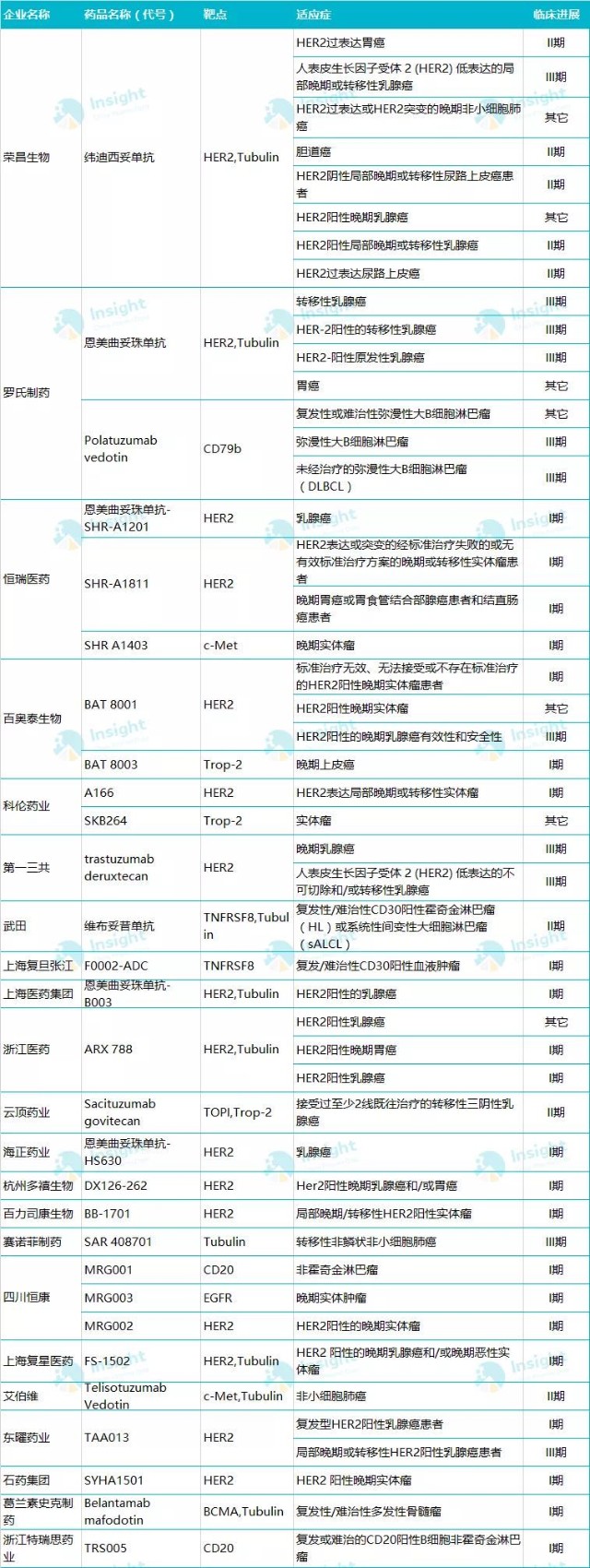
图|截至9月16日,国内进入临床阶段的ADC药物;统计:Insight数据库
ADC药物在2017年以前一直处于低谷期,整个市场仅有两款上市药物,且都用作二线用药,销量有限。但最近几年,受益于定点定量偶联技术、更新更优秀的小分子毒素的开发应用、以及抗体修饰技术的完善等方面的新突破,加上癌症联合疗法的大势所趋,ADC技术开始步入大规模应用阶段,同时也吸引了越来越多制药大厂的注意。
就在上个月(9月),外媒还传来重磅消息称,吉利德与Immunomedics接近达成超过200亿美元的收购协议,以获得热门ADC药物。去年初,一则“阿斯利康(AstraZeneca)斥资69亿美元之巨,以求与第一三共在全球范围内共同开发和商业化Enhertu(DS-8201)”的消息也曾震惊业界。
不甘落后,今年7月,齐鲁制药宣布,3500万美元从Sesen Bio公司手中取得ADC新药Vicineum在大中华地区开发和商业化的独家授权。此前,在2019年12月,君实生物(688180.SH;01877.HK)也曾花费3亿元,获得杭州多禧授权其在研ADC产品DAC-002(注射用重组人源化抗Trop2单抗-Tub196偶联剂)在亚洲地区(不含日本、韩国)进行临床试验、药品注册、商业化生产、销售及其他商业活动的权利,这是君实生物的首款ADC产品。
