做“双抗”赛道吃螃蟹者:康方生物-B(9926.HK)赴港IPO
新冠疫情席卷全球,在金融黑天鹅频发之际,作为传统防御板块的医药板块,正在受到资本界的额外关注。具有广谱性的肿瘤治疗新药PD-(L)1正在迅速普及全球癌症治疗市场,被称为“下一代抗体”的双特异性抗体的药企也在加快研发进程。
虽然双抗的技术更加先进,但生产与研发技术门槛相比起单抗更高,因此能够拥有双抗技术的公司少之又少,走在赛道前列的康方生物-B(9926.HK),近日也通过港交所聆讯,开始招股。根据公司披露,此次招股期为4月14日至4月17日,每股发售价14.88-16.18港元,每手1000股,入场费16343.05港元,摩根士丹利与摩根大通为其联席保荐人,预计4月24日上市。
在研产品管线亮眼
未盈利生物科技类公司的资质好不好,主要还是看他的研发能力强不强,首先来看康方生物的在研产品管线,主要特点是产品管线较多(相较于其他未盈利生物科技类公司),产品技术含量高,并且呈现多元化。
目前,公司共计拥有20多个药物开发项目,其中12个抗体处于临床阶段,6个双特异性抗体(两个处于临床阶段)以及4个抗体获得FDA的IND批准。自2017年以来,公司已经就创新候选药物启动22项临床试验。
公司的研发管线涵盖了PD-1、CD47、CD73、IL-12/IL-23、IL-17、IL-4R等与肿瘤免疫治疗和自身免疫相关的热门靶点。此外,产品的组合形式也是比较多样,有单克隆抗体,有单抗与其他药物联合的combo,还有一系列全球首创处在临床开发阶段的双特异性抗体。
图表一:在研产品管线

数据来源:招股说明书,格隆汇整理
AK104:潜在First-in-Class双特异性抗体,临床II期
PD-(L)1单抗药物的上市,为治疗肿瘤疾病提供了新的治疗方式,凭借着其具有广谱性的特点,成为近年创新药企研发的热门靶向候选药物。
然而,在治疗范围广之下,单一使用PD-(L)1抗体药物的效果并没有想象中那么好。根据Frost&Sullivan数据统计显示,在各种获批以及正在试验的实体瘤适应症的所有癌症患者中,相对较小比例的患者对PD-(L)1抗体药物显示出有意义的缓释,缓释率普遍较低。
图表二:PD-(L)1抗体药物单一疗法用于治疗实体瘤的缓释率
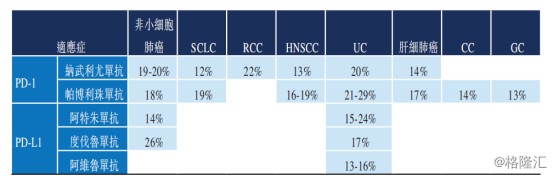
数据来源:Frost&Sullivan,格隆汇整理
那么是否有办法可以提高药物的缓释率?目前临床上比较有效的方式是采用联合治疗的方式,也就是多种治疗方式同时使用,可以有效改善治疗效果。例如,利用纳武单抗以及伊匹单抗同时靶向PD-1以及CTLA-4的联合疗法已被批准,患者的总缓释率大幅改善,治疗效果优于单一疗法。
在解决缓释率低的问题之后,还存在一个问题,那就是药物的毒性。虽然纳武单抗与伊匹单抗联合用药的治疗效果比单一用药好,但是不良事件的比率也在上升,这也使得不少科学家将目标转向双特异性抗体(BsAb),这个被《自然﹒综述:药物发现》杂志称为“下一代抗体”的新技术。
双特异性抗体,是一种可以同时结合两种特异性表位或目的蛋白的人工工程化抗体,具有同时结合两个不同表位的能力,可以起到一些特殊的生物学功能。
AK104是康方生物自主研发的全球首个进入临床试验的PD-1/CTLA-4的双特异性抗体,目标是在保留联合疗法的疗效的同时,也能够建立优于联合疗法的安全性。
从AK104的作用机理来看,作为一个新型的四价双特异性抗体,可以通过优先双重阻断肿瘤微环境中的两种经过验证的免疫检查点分子,来保留PD-1与CTLA-4单克隆抗体联合疗法
中观察到的疗效,同时降低活化T细胞攻击外周位点健康组织的倾向。
图表三:AK105作用机理
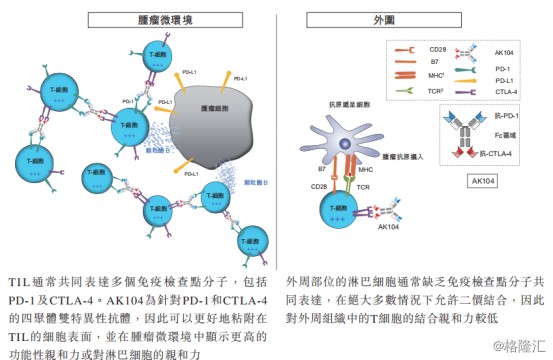
数据来源:招股说明书,格隆汇整理
独特的设计,也使得AK104存在以下优势:
(1)亲和力强。公司通过四价结构设计令AK104对有PD-1和CTLA-4共表达特点的肿瘤微环境而非正常外周血具有更高的亲和力;
(2)疗效好。根据公司此前披露的临床数据显示,在之前接受过大量治疗无效的癌症患者的试验中观察到良好的疗效;
(3)毒性弱。相较于PD-1与CTLA-4的联合疗法,AK104的不良反应率较低,毒性较弱。
(4)专业的临床开发计划。除了产品设计优势外,凭借康方生物的专业研发团队以及清晰的临床试验开发计划,相信会让AK104的各种适应症获快速批准,迎合广阔的市场机遇。
从临床进度上来看,AK104已在澳洲启动Ia/Ib期试验,并在中国启动五项Ib/II期及II期试验,包括两项Ib/II期篮子试验,涵盖多种肿瘤类型。2019年3月,公司已获得FDA针对评估AK104的IND批准。2020年1月,公司就一项于美国对2L/3L子宫颈癌患者进行的计划注册试验整体研究设计获得FDA书面同意,并有可能通过快速审批通道向FDA提交子宫颈癌NDA申请,预计将于2021年下半年在中国提交AK104治疗子宫颈癌的首次NDA。
从竞争情况上来看,AK104处于同业领先的情况。目前,FDA仅获批了2种双特异性抗体,其中只有一种是肿瘤免疫疗法。而在临床研究中,根据Frost&Sullivan数据统计显示,截止2019年9月30日,全球共计拥有90多种双特异性抗体正在进行临床试验,其中18种双特异性抗体至少针对一个免疫检查点,例如PD-(L)1。康方生物的AK104,是全球首个进入临床试验的同时拥有PD-1与CTLA-4靶点的双特异性药物,也是目前国内市场上基于PD-(L)1的双特异性抗体的在研产品中,位列第一梯队的药物。
AK105:潜在Best-in-Class单克隆抗体,临床III期
AK105是由康方生物自主研发的重组人源化抗PD-1 单克隆抗体。2019年6月17日,中山康方生物医药有限公司( "康方生物 ")宣布,康方生物与中国生物制药有限公司("中国生物制药")旗下的正大天晴药业集团股份有限公司( "正大天晴")签订合营合同,成立合营公司,共同开发康方生物的PD-1抗体 AK105 项目("AK105 项目")并全力推动该药物的注册上市及商业化。
相较于市面上已经销售的PD-1抗体,作为具有差异化的潜在同类最佳的PD-1单抗penpulimab(AK105)具有以下优势:
(1) 结构设计独特。通过差异化结构设计(i)去除Fc受体介导效用功能从而基本去除ADCC效应,增加抗肿瘤活性及(ii)导致解离速率较慢,受体占位较好;
(2) 临床试验数据优秀。根据公司此前披露的临床试验中可以观察到,AK105拥有强大疗效数据及良好安全性;
(3) 强强联合进行开发研究。作为中国生物制药唯一可用于开发的基于PD-1抗体单一疗法或联合疗法(如与正大天晴的安罗替尼联用)的产品,同时针对一系列关键适应症正在临床开发后期;
(4) 销售能力强。中国生物独家销售权,公司将利用中国生物制药约 12,000名专业人员的强大销售团队为AK105商业化保驾护航。
从临床进度上来看,目前AK105项目正在中国和澳洲启动7项临床研究,其中在中国进行专注于安罗替尼联合试验的5项注册试验。根据目前的临床开发状况,预计将于2020年中在中国提交penpulimab(AK105)治疗复发性或难治性经典型霍奇金淋巴瘤的首次NDA。
强大的技术与平台铸就“护城河”
2000年前,全球获批的单克隆抗体药物屈指可数,限制其开发的最大的瓶颈就是生产工艺和规模化生产。伴随着抗体生产CMC的成熟发展,单克隆抗体药物如同雨后春笋,基于同一个靶点开发的单抗更是鳞次栉比。
而康方生物深耕的双抗赛道,正如同早期的单克隆抗体药物一般,研发门槛高,生产门槛更高。但是此时的康方生物已经拥有完善的技术平台与一体化生产能力作为其领先优势的“护城河”。
在技术平台上,康方拥有独特的Tetrabody双功能抗体技术,成为现有屈指可数的获得生产和临床验证的双抗平台之一。由Tetrabody技术开发出的AK104和AK112双抗都是全球首创,全球最先进入临床的双抗新药。
在生产上,如何能够在工业上进行大规模、稳定地生产成为后续开发双抗的难点所在。目前,公司拥有的ACE平台具有符合NMPA、FDA及EMA监管的国际GMP标准的强大内部生产能力。2016年,公司建立了华南地区第一家采用具有中央控制系统的GE FlexFactory技术的生物制剂生产设施,从而可以最短生产周期及较低经营成本来快速扩大生产规模或在各种候选药物之间切换生产。
此外,公司正在广州一幅56,573平方米的土地上兴建另外一个新生产设施,估计总共可容纳40,000升的生物反应器,其中包括土地一期施工中配备的最多八个2,000升生物反应器,总容量达16,000升,预期于2020 年底前完成安装及投入营运。
获多家机构看好,现金充裕
那么对于康方生物的产品和技术,用脚投票的资本市场是如何看待的?从此前公布的融资情况来看,公司的获得同业以及著名PE/VC机构看好。
其中,投资机构主要包括与港股生物医药第一蓝筹股中国生物制药公司(01177.HK),以及善于投资长线及国际专业医疗投资基金例如清池资本、奥博资本、杏泽资本、交银国际、建信资本等机构。
那么在融资之后,面对正在处于临床后期烧钱的康方,他的现金状况如何?
翻看招股说明书可以看到,公司的现金流还算是充裕,手有余粮,心中不慌。公司在2019年底,现金及现金等价物拥有11.86亿元,到了今年的2月29日为止,也还是拥有8.67亿元的现金及现金等价物,能够继续支撑公司进行临床的研发与生产。
图表四:公司现金状况
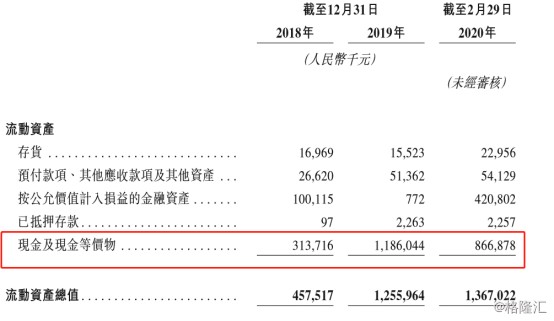
数据来源:招股说明书,格隆汇整理
小结
在康方生物上市之前,我们已经看到有一些老牌的药企以及Biotech类公司开始布局双抗市场,但从布局到临床研发,这意味着已经过去了4年以上的前期临床研究时光。换言之,相比起如今准备开始布局的企业,康方实际上在这个领域已经着实领先了很多。而到了大家都能够开始研发的阶段,康方生物又凭借早先布局的生产与技术平台,能够早进行批量化生产,成为这个赛道上“吃螃蟹”之人。
而这,仅仅只是公司研发的一小部分。在这个追求创新的时代,license-in极其普遍,但是康方所有项目全部自我研发,建立了中国最完善的In-House抗体新药开发和产业化体系,也开发出中国最丰富、最多元化的新药产品管线之一。早在2015年,公司更是凭借强大的研发实力和商业开拓能力,成为了中国第一家向全球制药巨头默沙东授权自主研发抗体许可的中国生物科技公司。从自主研发再到license-out,康方生物走的远比想象中的多,走得远。
