基石药业-B(2616.HK):肿瘤药物获批上市,内部研发驱动迈入2.0时代
昨夜,美国股市经历了自1987年10月以来最惨的一夜,道琼斯指数收跌接近3000点,跌幅接近13%,创三年以来新低。然而,Blueprint Medcines在美股开盘遭遇熔断之际,却因公布关于avapritinib作用于惰性系统性肥大细胞增多症(SM)重要临床数据以及成为首个获得美国FDA批准的胃肠道间质瘤(GIST)精准疗法,逆势上涨,盘中最高涨幅达到19%。
图表一:Blueprint股价走势图
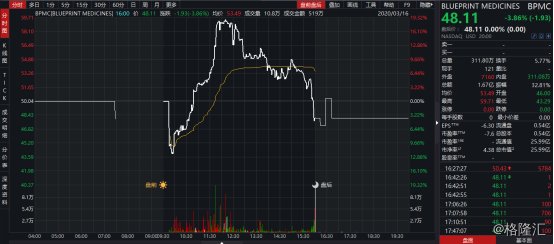
数据来源:WIND,格隆汇整理 数据为2020年3月16日当日走势图
作为拥有avapritinib中国独家许可权的基石药业-B(2616.HK),近段时间频出研发喜讯,一则是全球首款胃肠道间质瘤精准靶向药AYVAKITTM美国获批上市,另一则消息则是pralsetinib主要临床试验数据,已启动美国FDA新药上市滚动申请。此外,2020年基石药业成功在美国纽约举办研发论坛,并与国内外顶尖学者与专家共同探讨了中国肿瘤治疗领域变革发展的新趋势。
值得注意的是,伴随着公司肿瘤药物获批上市,公司也在进一步完成“管线2.0”的创新升级,并向成熟的创新平台与商业化阶段转型,并在未来2-3年内将新药适应症申请扩大至近10个品种。

全球首款胃肠道间质瘤精准靶向药美国获批上市
3月16日,基石药业的合作伙伴Blueprint 公布,avapritinib在作用于惰性系统性肥大细胞增多症(SM)的临床试验PIONEER带来了好消息。
根据avapritinib在PIONEER 临床II期试验中的最新结果显示,avapritinib用于惰性系统性肥大细胞增多症(SM)患者与安慰剂相比具有显著的临床改善,具有良好的耐受性,没有患者因不良事件(AE)中断治疗。
具体来看,在PIONEER试验的第1部分中,用惰性SM症状评估表(ISM-SAF)进行了测量,接受avapritinib治疗的患者在16周时的总症状评分(TSS)平均下降了约30%,具有统计学意义,且症状评分降低的程度随着时间的推移而加深。此外,用avapritinib治疗的患者在客观指标方面,包括肥大细胞负荷及患者报告的生活质量均取得了持续的改善。根据第1部分的完整数据,患者已选择25毫克每天一次(QD)作为临床II期试验的推荐剂量(RP2D)。这部分数据将会在美国过敏学会、哮喘和免疫学(AAAAI)虚拟论坛上展示。
值得注意的是,Blueprint 研发的AYVAKITTM(avapritinib)此前已经成为首个获得美国FDA批准的胃肠道间质瘤(GIST)精准疗法,也是PDGFRA外显子18突变体(包括D842V突变)GIST的唯一高活性疗法。
胃肠道间质瘤(GIST)是一种罕见的由基因组驱动的胃肠道肿瘤,是最常见的消化道间叶性肿瘤。
然而在GIST患者中,大约有6%的患者具有血小板衍生的生长因子受体α(PDGFRA)外显子18突变,主要为D842V位点突变,这部分患者无法通过现有治疗方式进行治疗,并对已有药物产生抗药性,一项回顾性研究数据显示,患者接受伊马替尼治疗时,缓释率(ORR)为0%。
FDA根据全球多中心I期NAVIGATOR临床试验的数据,以及avapritinib多项临床试验的综合安全性结果,授予了AYVAKITTM完全批准。Blueprint 公司已计划在一周内将Ayvakit推向美国市场。
在PDGFRA基因18号外显子突变的GIST患者中,Ayvakit治疗的临床数据显示:
客观缓解率(ORR):86%(95%CI:69%,93%),且中位缓解持续时间(DOR)尚未达到。
不良反应: 20%以上患者中常见的为1-2级的水肿、恶心、疲劳/乏力、贫血、认知影响、呕吐、食欲下降、腹泻、发色改变、流泪增多等。
在宣布FDA批准Ayvakit的同时,Blueprint 公司还宣布,FDA已将最初提交的新药申请(NDA)中avapritinib拟议的适应症分为了2个单独的NDA:一个是FDA此次批准的PDGFRA外显子18突变GIST,另一个是四线GIST标准治疗。
四线GIST适应症的处方药用户收费法(PDUFA)目标日期为2020年2月14日。如前所述,对于四线GIST的NDA,可能需要将PDUFA目标日期延长3个月,以便Blueprint 公司向 FDA提交III期VOYAGER研究的关键数据,该研究正在评估avapritinib与瑞戈非尼(regorafenib)在三线或四线GIST的疗效。2019年ASCO年会上公布的数据透露,avapritinib治疗四线GIST的总缓解率(ORR)为22%,中位缓解持续时间(DOR)达到10.2个月。
总体而言,在avapritinib药品用于治疗GIST上公司在2020年的预计研发计划为:
图表二:2020年关于avapritinib的研发计划表
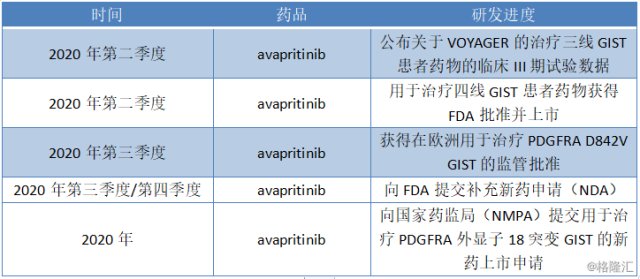
数据来源:公司公告,格隆汇整理
从市场空间上来看,基石药业已经拥有关于avapritinib的中国独家许可权。根据Frost&Sullivan数据统计显示,中国胃肠道间质瘤的发病人数已经由2013年的2.62万例增加至2017年的3万例,复合年增长率为3.4%,预计2030年将增长至4.33万例。
图表三:中国市场胃肠道间质瘤(GIST)的发病人数
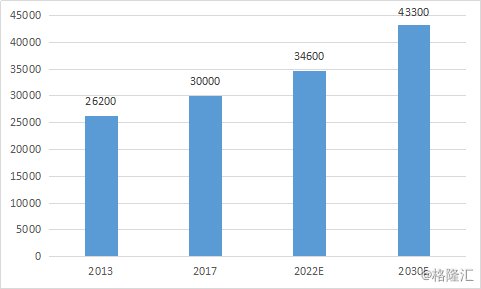
数据来源:Frost&Sullivan,格隆汇整理
另一款抗癌药也在获批路上
2020年1月8日,基石药业的合作伙伴Blueprint Medicines公布了pralsetinib 关于治疗RET融合非小细胞肺癌(NSCLC)的主要临床数据,并已启动美国FDA新药上市滚动申请。
Pralsetinib是一种口服(每日一次)、高效和高选择性的靶向致癌性RET变异的在研药物。与目前市面上的多激酶抑制剂不同,pralsetinib能够有效的与RET特异性结合,从而可以选定指定靶点并且使得脱靶毒性降至最低。
此前,美国FDA已经授予pralsetinib突破性疗法认定,用于治疗经含铂化疗进展的RET融合非小细胞肺癌、和需要系统治疗且没有可替代治疗方案的RET突变甲状腺髓样癌患者的治疗。
此次公布的临床I/II期ARROW研究数据显示:
对于80例既往接受过含铂化疗治疗的RET融合NSCLC患者,客观缓释率ORR为61%(95%CI:50-72%),其中95%患者观察到患者中观察到了影像学肿瘤缩小,其中14%患者达到目标肿瘤的完全缓解。至数据截止,中位DOR尚未达到。
对于26例初次治疗RET融合NSCLC患者,总缓释率ORR为73%(95% CI:52-88%),其中12%的受试患者达到完全缓解,100%患者中观察到影像学肿瘤缩小。
根据Blueprint官网显示,在pralsetinib药品研发上公司2020年预计将实现以下目标:
图表四:2020年pralsetinib的研发计划表

数据来源:公司公告,格隆汇整理
从市场空间上来看,基石药业已经拥有关于pralsetinib的大中华地区独家许可权。根据Frost&Sullivan数据统计显示,pralsetinib用于两种适应症中,在非小细胞肺癌上,中国患病人数庞大,2013年为64.05万人,预计在2030年将达到约107万人。而在甲状腺髓样癌上,患病人数增长迅猛,2013年患病人数为4200人,到了2017年则达到9100人,复合年增长率为21%,预计到2030年复合年增长率将放缓至11.3%,2030年患病人数达到3.67万人。
图表五:中国非小细胞肺癌NSCLC(左)与甲状腺髓样癌MTC(右)患病人数
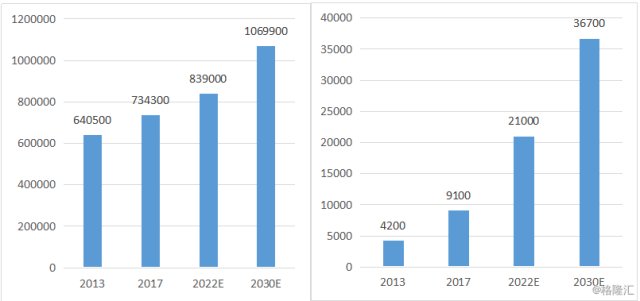
数据来源:Frost&Sullivan,格隆汇整理
小结
基石药业在上市之初,就以抗肿瘤药物配合肿瘤免疫(IO)联合疗法为其核心的产品管线著称,也有望成为肿瘤领域联合疗法生物科技公司的代表企业。
此次公布的两款药物的研发进展,都是从Blueprint手中拿下大中华地区独家开发和商业化许可的抗肿瘤领域的优质药物。
Avapritinib早前就成为治疗GIST和SM的孤儿药,并且已经获得FDA的突破性治疗认定。此次获得美国FDA批准上市,成为全球首款胃肠道间质瘤精准靶向药,这将打开全球市场格局,并为未来基石药业在大中华地区销售打下扎实的基础。
另一款用于治疗NSCLC和MTC的pralsetinib,此前也被FDA定义为用于治疗RET改变的NSCLC患者的罕用药以及用于治疗RET突变阳性MTC的突破性疗法认定。此次提交FDA滚动上市申请,也为肿瘤领域中大适应症非小细胞肺癌患者带来福音。
总体而言,面对基数庞大但仍不断增长的肿瘤领域,传统治疗方式已经开始转变为更加先进科学的靶向以及肿瘤免疫疗法。从支付端来看,能够支付癌症治疗费用的人群在不断扩大。从政策上来看,医改政策频发,创新药也正逐步纳入医保范围内,药品售价逐渐趋于平民化,这将为中国的抗肿瘤药物带来新的机遇与挑战。拥有平价而疗效好的药品,方能成为行业赢家。而在这方面,基石药业的两款药疗效好,全球首发获批上市以及在获批上市路上,第一个吃螃蟹的人,值得期待。
