新冠疫苗的希望,新贵Moderna为何方神圣?
作者 | 胡一
数据支持 | 勾股大数据

近日,美国一家独角兽Moderna Therapeutics?(MRNA.O)进入世界的眼帘,起因是因为该公司的实验性mRNA COVID-19疫苗mRNA-1273已被运送给美国过敏和传染病研究所的美国政府研究人员,公司预计该疫苗的第一批临床试验将于4月下旬开始,大约有25名健康志愿者参加这些实验,初步的试验结果预计于7月或8月提供。这无疑不是振奋人心的又一新的消息。
那么,这个陌生的名字背后,是一个怎样的故事呢?
1
Moderna并不是一个默默无闻的公司,相反的,它却是只颇为高调的生物科技独角兽。2018年美股中最大的生物科技公司IPO就被Moderna一举夺下,而这也是至今为止就生物技术这个赛道中最大规模的IPO之一。
Moderna的技术创始人是Robert Langer(罗伯特·兰格)和Derrick Rossi(德里克·罗西),他们的故事,其实是个奇遇记。
Derrick Rossi在去哈佛之前,在加拿大、巴黎、得克萨斯州、芬兰都游过学,几个城市不断折腾的他,外人看起来怎么还不安定,实质上正是这一路的“折腾”让他接触到了多个研究的领域,为后续的成就铺好了路。当时的他还没有深入干细胞领域的研究,但是抗衰老的话题已经开始小露尖尖角,在芬兰的赫尔辛基大学博士毕业后,Rossi选择了斯坦福大学进行干细胞和衰老领域的深入研究。2007年Rossi选择了在哈佛医学院助理教授的位置,并有了自己的实验室开始进行造血干细胞的研究。有一天,Rossi读到了日本科学家山中伸弥发表的研究论文,文中指出,通过慢病毒载体将Oct4、Sox2、c-Myc、Klf4这四种转录因子基因转入成体细胞,再将成体细胞转化为类似于胚胎干细胞的多能干细胞(iPS细胞)。这是个极具意义的研究发现,因为早期干细胞的研究一直依赖于胚胎干细胞,而胚胎干细胞又来源于废弃的胚胎,这里面存在着许多伦理问题,而山中伸弥团队的诱导多能干细胞技术可以解决这其中的问题,所以山中伸弥也因此获得了2012年的诺贝尔奖。
由此,Rossi又激发了新的想法,山中伸弥的iPS技术若用于治疗疾病上,仍有缺陷存在,如果DNA病毒作为基因载体来诱导正常细胞转化的过程中,也可能会诱发细胞基因组的突变,那么Rossi就想,或许使用mRNA作为遗传物质来表达这些转录因子,就不会整合进入靶细胞的基因组,那么就不会存在诱发突变的风险。一年半后,Rossi团队里的博士后Luigi Warren完成了试验研究,但Rossi不想让试验只存在于报告上,更希望可以将其转为商业化运用,经人引荐,他认识了Robert Langer,故事的另一主人翁。
Robert Langer早已是颇有名气的科学家,说起生物材料领域,科研人员都会想到麻省理工Langer的课题组,他们拥有全美最大的生物医院工程实验室。Langer本人申请过900多项专利,其中400多项已经授权,发表的研究论文高达1200多篇,在43岁时已经获得美国科学院、美国工程院和医学院的院士头衔,是当时美国最年起的“三院”院士;而之所以称他为美国最有钱的科学家之一是因为,Langer带着他的学生们共创立了25家公司,覆盖生物科技、医疗器械等。普通人最容易了解到的就是,Living Proof这个美容产品的公司,其洗发水中用到的Polyalkylaminoester-1的聚氨基酯就是Langer团队在进行基因疗法的研究过程中发现的。
1974年,Langer在麻省理工学院毕业获得了博士学位,埃克森美孚等大型的石油公司抛来了橄榄枝,但是Langer一直希望转入医学界,在朋友的帮助下进入了波士顿儿童医院做博士后,开始研究抑制癌细胞中血管生成的方法。好似一只脚已踏入正轨,但后续的道路依然艰难,研究申请不到基金,研究成果没有大公司合作,研究方向过于超前,比如透皮给药系统,在当时并没有得到公众的认可,反而给带上了不懂医学也不懂生物学的帽子。然后没有人的认可再艰难,Langer还是坚持下来了,1987年,Langer与同事创立了第一家公司,进行糖尿病等领域的药物释放体系研究,后被收购,但也开启了Langer进行科学研究和商业实践结合的路程。
成功后的Langer非常的忙碌,能约上交流的客人一般也只有不到半个小时的交谈实践。2010年5月的一天,Rossi前往麻省理工与Langer会面,Rossi给Langer讲解他的使用mRNA作为遗传物质来表达转录因子的试验数据,通过修饰mRNA的核苷酸避免固有免疫系统的识别,因而可以突破细胞自身的防御机制,顺利进入细胞内部后翻译为相应的蛋白质,就可以使成体细胞成功的转化为iPS细胞。这场会面进行了2个小时之久,而Langer从中获取的兴趣点并不是iPS细胞,而是中途用到的mRNA传递至细胞内部的方法。
得到Langer的兴趣后,Rossi又马不停蹄的见了Flagship Ventures风投公司的CEO Noubar Afeyan,哈佛大学主做心脏干细胞的科学家Ken Chien,他们对于此发现都抱有极大的兴趣和想象空间,几人和聚在一起,2010年开创了Moderna,这个名字Rossi称他为Modified RNA(RNA修饰)缩写。
2011年初,需要为公司寻找一位CEO,这就有了Stephane Bancel的加盟,Stephane Bancel曾是法国一家诊断公司BioMerieux的CEO,当时公司只有少许的几个人,但Bancel依然放弃了高薪的职位来接受Moderna的邀请,他称之为“如果拒接了这份工作,就是拒绝了去管理有可能成为下一个基因泰克的公司的机会,那将永远无法原谅自己。”
2
专利之争虽然一直是市场围绕Moderna争议的话题,但是资本上依然很青睐于他。2012年12月前进行了第一轮的融资,融资金额为4000万美元;2013年11月进行了第二轮的融资达到1.1亿美元;2015年1月进行了第三轮的融资,融得4.5亿美元,2016年9月进行第四轮融资,获得4.7亿美元;2017年2月进行了第五轮的融资,获得5亿美元;2018年2月再次进行融资,获得5亿美元,是的公司的估值升至70亿美元。2018年12月7日,Moderna在纳斯达克上市募资6亿美元,发行市值75.65亿美元,每股价格23美元,这是2018年美股中最大的生物科技公司IPO,这也是至今为止就生物技术这个赛道中最大规模的IPO之一。
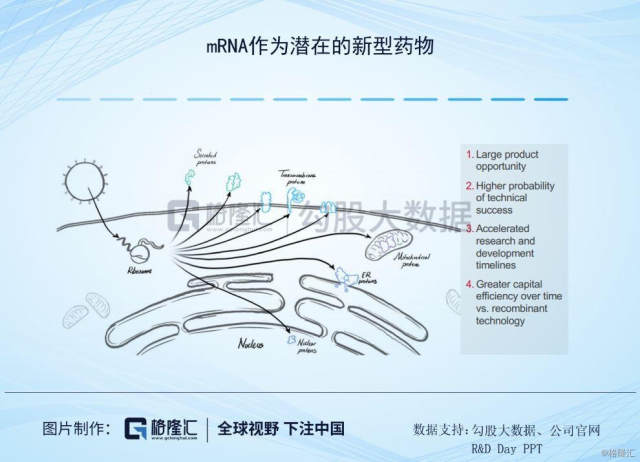
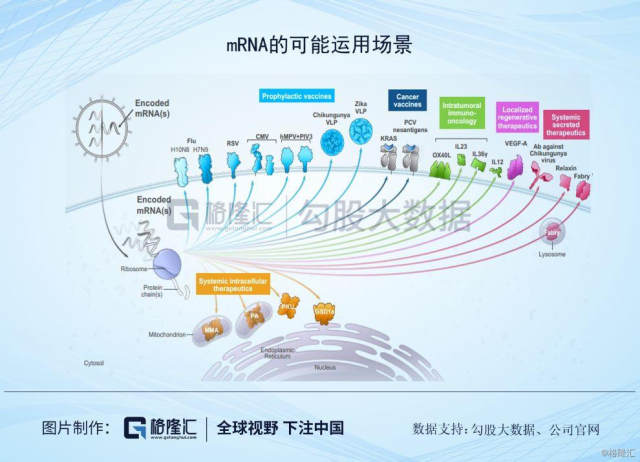
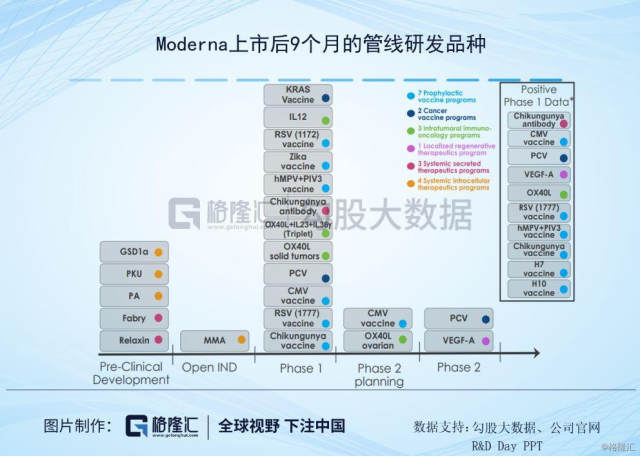
抛开其他的争议,来看下Moderna的管线结构。Moderna创立后的第一个项目其实是与Alexion Pharmaceuticals 共同开发的一种治疗罕见病 Crigler-Najjar Syndrome (克果纳杰氏症)的mRNA药物,当时预计在2016年进入临床试验,但因为在临床前研究并没有达到可以进入人体试验的安全性要求,因此在2017年7月与Alexion终止了合作。这样的安全性问题不止发生在与Alexion合作项目上,在其他的项目上也出现过类似的状况,因此Moderna的研发重点就从利润较高的罕见病用药,转向为竞争较为激烈的疫苗项目,主要针对传染性疾病疫苗和肿瘤疫苗领域。
RNA疫苗相对于DNA疫苗更具安全性,也不需要进入细胞核更容易表达,生产也相对简单,但也存在着问题比如RNA免疫原性强,以及也不太稳定。但发展至今,需要步骤已经逐步成熟,比如RNA化学修饰、递送技术、测序成本也会大幅下降。
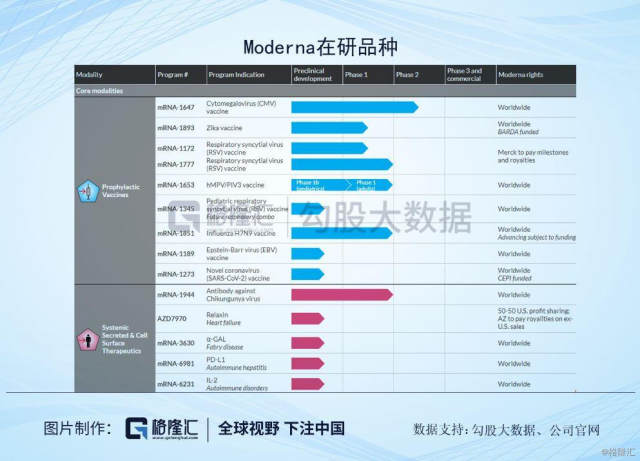

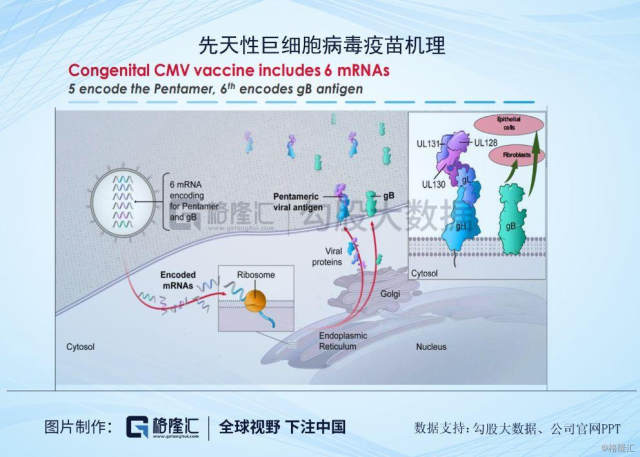
目前公司管线走在较为前列的是Cytomegalovirus (CMV)vaccine (mRNA-1647)巨细胞病毒疫苗,这是一种疱疹病毒组DNA病毒,由于感染的细胞肿大,具有巨大的核内包涵体,会引起生殖泌尿系统、中枢神经系统和肝脏疾病患为主的系统感染,这个病毒对宿主或培养细胞有报读的种特异性,感染小儿多表现为无症状性感染,或者只有少数症状感染,在严重免疫缺陷时,会出现肺炎、肝炎等全身疾患。在人群中感染较为广泛,多数感染者无临床症状,但会在一定条件下侵入其他器官及系统导致严重疾病。目前Moderna已经进入II期临床阶段,7个月的中期数据分析显示,疫苗一般耐受良好,没有与疫苗相关的严重不良事件(SAE)。 300μg剂量水平的安全性和耐受性与180μg剂量下的安全性和耐受性水平相当。若能顺利获批上市,公司预计这个疫苗的销售峰值在20~50亿美元。
3
小结
mRNA药物描绘出了一个巨大想象空间,阿斯利康、默克等大型药企也与Moderna签署合作,并支付合作款项,在公司公布2019Q4业绩净亏损扩大至1.24亿美元后,当日股价依旧大涨22%,华尔街给予了很高的期望。近日,新冠在全球的蔓延,让大家对于疫苗的渴求更加的强烈,公司总裁Stephen Hoge也表示,第一批已经送至NIH(美国国立卫生研究院)进行临床I期的试验,而公司已经于2月7日完成了内部的临床I期试验,其中包括进行病毒灌注等。然而对于提到生产还为时过早,包括工业制作流程也并不成熟。但新的技术新的方法,带来的不仅是资本的受益,更多是对于抗病毒的新的希望与利器。期盼着独角兽们,撑得起这样的头衔,造福人类。
